Es gibt keine Website-Inhalte zu Ihrer Suchanfrage.
Website-Inhalte
Sie haben sich erfolgreich abgemeldet.
Noch nicht registriert?
Realisieren Sie neue Räume für Fusion
Inspiriert von der menschlichen Anatomie, unterstützt durch die Wissenschaft – unsere Cages verbinden technologische Fortschritte mit klinischen Werten. Das Ergebnis ist ein großer Entwicklungssprung bei der anterioren und posterioren Stabilisierung.
Der Inhalt dieser Webseite ist nur für Personen vorgesehen, die im Gesundheitswesen tätig sind (Health Care Professionals = HCP). Mit Klick auf „Bestätigen“ erklären Sie, dass Sie eine Fachperson im Gesundheitswesen sind. Ist dies nicht der Fall, klicken Sie auf "Abbruch" und besuchen Sie unsere öffentlich zugänglichen Seiten.
Structan®
Sie denken, das sei ein gewöhnliches Cage-Gitter? Lassen Sie sich von der Wissenschaft hinter Structan® beeindrucken. Jahrzehntelange Erfahrung in Kombination mit moderner Technologie hat zu ihrer Entwicklung geführt – eine Struktur, die für verbesserte klinische Ergebnisse und fortschrittliche biomechanische Leistung entwickelt wurde.
Die Oberfläche wird vergrößert um den Faktor
0
Dies bietet mehr Möglichkeiten für das Knochenwachstum.
Stark und elastisch zugleich – Structan® ist
0 %
näher am Elastizitätsmodul des kortikalen Knochens. (1–4)*
Ermöglichen Sie die posteriore Stabilisierung mit nur
0
modularen Wirbelsäulenplattform, die sich genau an Ihre Bedürfnisse anpasst.
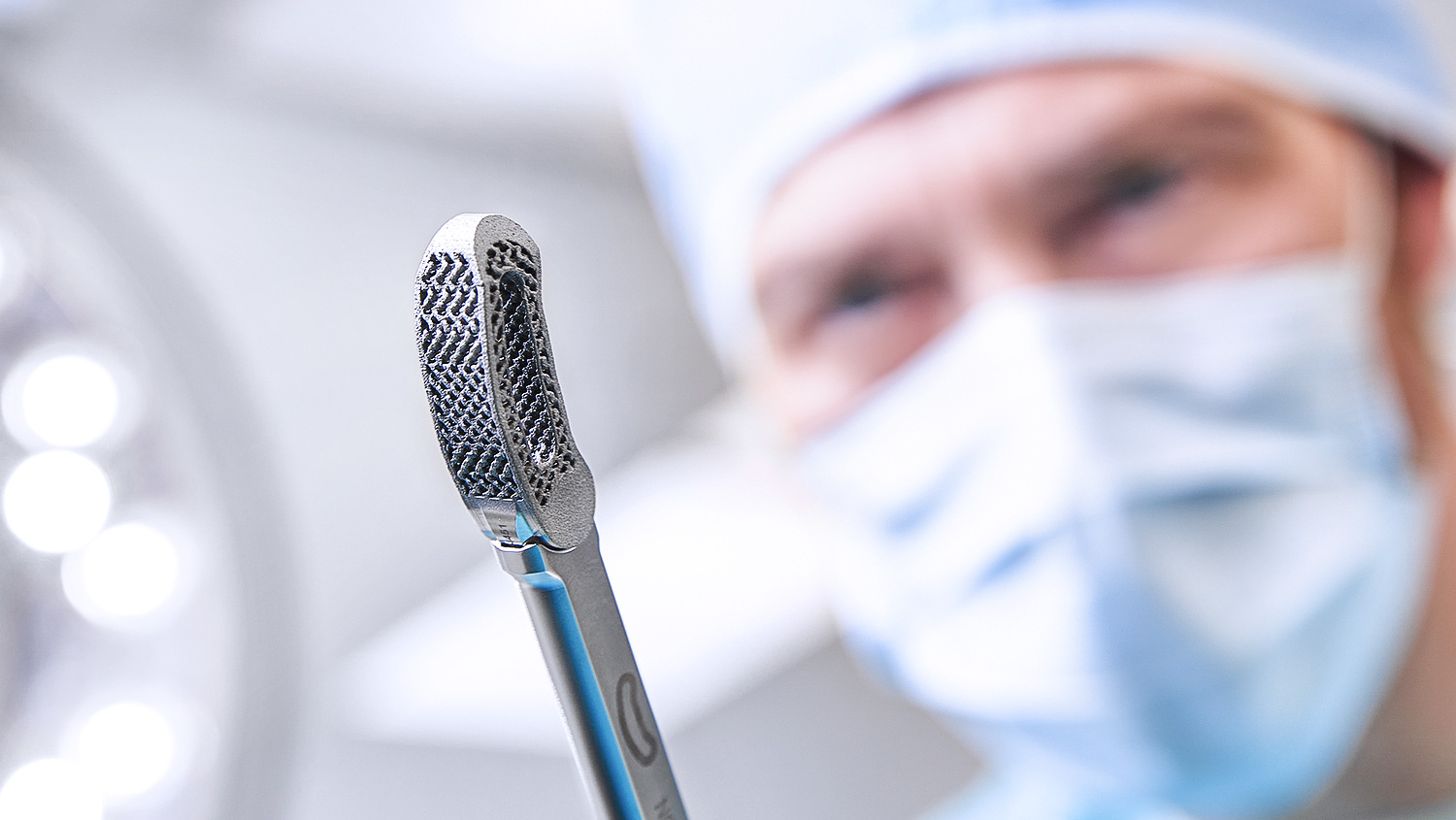
Die fein ausgeglichene Oberflächenstruktur wirkt sich positiv auf die Adhäsion von Osteoblasten aus. Die angepasste Porosität bildet eine solide Basis für das Einwachsen von Knochen und die Fusion mit Structan®. [5–8]
/
Substanzielle osteoblastische Differenzierung und verbesserte Osseointegration – unsere AESCULAP® 3D Cages spiegeln die biologischen Eigenschaften der trabekulären Struktur wider und fördern das Einwachsen von Knochen.[9–15]
/
Intelligent gestaltetes Transplantatfenster zur Unterstützung der Osseointegration zwischen Knochen und Implantat – mit oder ohne Autograft oder Allograft.
/
Die smarte Schnittstelle sorgt für eine feste Verbindung zu den Instrumenten und eine hohe Präzision bei der Handhabung. Das können Sie mit unserem artikulierenden Einführinstrument bei TLIF-Verfahren regelrecht spüren.
/
AESCULAP® 3D-gedruckte Cages
Wie bei der Entwicklung aller unserer Wirbelsäulenlösungen orientiert sich das Design der AESCULAP® 3D-Wirbelkörperfusionsgeräte an unseren Kernwerten: fortschrittliche biomechanische Leistung, intraoperative Flexibilität und verbesserte klinische Ergebnisse.
Additive Fertigung

Structan®
Das Portfolio
Aescula
Animationen zum chirurgischen Arbeitsablauf
Sehen Sie sich die Leistungsfähigkeit der AESCULAP® 3D-Cages und Ennovate® an.
Unser TLIF ermöglicht mit seinem artikulierenden Einführinstrument minimalinvasive Fusionsverfahren.
Mit der optimierten Operationsmethode eignen sich unser PLIF-Cages gemeinsam mit Ennovate® ideal für den offenen Ansatz.
Die Essenz zweier Welten vereint – unser TLIF-Cage kann sowohl minimalinvasiv als auch offen implantiert werden.
Entdecken Sie die AESCULAP® Wirbelsäulenplattform
*compared to solid titanium alloy interbody fusion devices.